 Allgemeine und Anorganische Chemie (AC1)
Allgemeine und Anorganische Chemie (AC1) Die meisten der vierfach koordinierten Moleküle in dieser Vorlesung haben Tetraedergestalt. Dabei bilden die vier Substituenten die Ecken eines Tetraeders, dessen Schwerpunkt vom Zentralatom belegt ist. Um dies darzustellen, werden die vier Substituenten in der Form eines Quadrats um das Zentralatom herum gezeichnet, so wie dies in der rechten Formel gezeigt ist. Eine ausdrückliche Betonung der Tetraedergestalt wie in der zweiten Formel von links (Keile laufen auf den Betrachter zu, gestrichelte Bindungen weisen nach hinten) bedeutet dasselbe, ebenso eine weitere verbreitete Schreibweise, bei der die Keile zu einer fett gezeichneten Bindung vereinfacht sind. Wenn Sie schon mit der Symmetrielehre vertraut sind: die Darstellung entspricht der Projektion entlang einer der S4-Achsen eines Tetraeders:
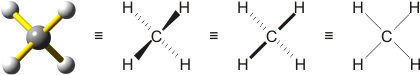
Sollte in der Vorlesung einmal ein quadratisch-planares Molekül auftreten, so wird dies schräg zur Flächennormale projiziert, um keine Verwirrung aufkommen zu lassen. Beispiel:
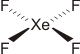
Die chemische Nomenklatur wird von der International Union of Pure and Applied Chemistry (IUPAC) festgelegt. Das ausführliche Erlernen der Nomenklatur soll in der Grundvorlesung nicht Selbstzweck sein. Sie finden daher hier nur einige wichtige Regeln, die in der Vorlesung beachtet werden.
Hier werden in der Mitte des PSE die auf -an endenden Namen verwendet: Borane, Silane, Phosphane. Weiter links dann Schwefelwasserstoff und die Halogenwasserstoffe. Die Vorsilbe „Mono“ je nach Bedarf: wenn man in den nächsten Minuten über Diphosphan reden wird, sagt man zu PH3 besser vorher Monophosphan, sonst einfach Phosphan.
Element[Zahlwort]halogenid ist die übliche Bezeichnung: Bortrifluorid, Siliciumtetrachlorid, Phosphorpentafluorid, Schwefeldichlorid, Chlortrifluorid. Die „-an“-Nomenklatur kann benutzt werden, um Zusammenhänge besser darzustellen: Siliciumtetrachlorid kann man auch Tetrachlorsilan nennen, wenn es zusammen mit Trichlorsilan abgehandelt wird.
Hypophosphorige Säure und phosphorige Säure sollte vermieden werden, wenn die wirklich vorliegenden Isomere gemeint werden, also Phosphinsäure und Phosphonsäure mit Phosphinat und Phosphonat als Anionen. Die beiden Tautomere von H2SO3 heißen schweflige Säure mit den Sulfiten und Sulfonsäure mit den Sulfonaten. Bei den Halogenen gibt es die hypohalogenigen und die halogenigen Säuren, die Halogensäuren und die Perhalogensäuren mit Hypohalogeniten, Halogeniten, Halogenaten und Perhalogenaten. HOF ist hypofluorige Säure.
Wasser als Ligand heißt „aqua“, Ammoniak „ammin“, Hydroxid „hydroxido“ – es erhält die Endung „o“ wie alle anionischen Liganden (fluorido, chlorido, sulfato, nitrato, …). Die Zahl der Liganden wird meist auf griechisch angegeben (mono, di, tri, tetra, penta, hexa, …); [Al(H2O)6]3+ ist daher das Hexaaqua-aluminium-Ion. Besonders, wenn der Ligandname selbst mit einem Zahlwort anfängt oder anfangen könnte, wird anders gezählt (bis, tris, tetrakis, pentakis, …), damit es keine Verwirrung gibt: So nennt man die Komplexe des Waschmittelzusatzes Triphosphat Triphosphato-Komplexe, während Komplexe mit drei Orthophosphato-Liganden zur Unterscheidung Tris(phosphato)-Komplexe genannt werden. Ist der Komplex ein Anion, wird das Zentralatom neulateinisch bezeichnet und mit der Endung „-at“ versehen: [Au(OH)4]− ist das Tetrahydroxido-aurat(-Ion); das „Ion“ ist nicht unbedingt nötig. Ist im Komplex mehr als eine Ligandsorte enthalten, so werden diese alphabetisch geordnet. Die Oxidationsstufe wird dort angehängt, wo sie nicht selbstverständlich ist.
Weitere Beispiele aus der Vorlesung:
[Al(H2O)5(OH)]2+: Pentaaqua-hydroxido-aluminium(-Ion)
[Fe(H2O)5(OH)]2+: Pentaaqua-hydroxido-eisen(III)(-Ion)