2.2 Koodinierende Lösungsmittel für Cellulose
Die Menge an natürlichen Cellulosefasern ist für die Textilindustrie unzureichend. Daher wurden schon im 19. Jahrhundert Anstrengungen unternommen, die unlösliche Cellulose in lösliche und dann verspinnbare Produkte umzuwandeln. Die grundsätzlichen Eigenschaften eines Lösungsmittels für Cellulose werden in Kettenbach et al. 1997zusammengefasst.
Cellulose als einer der wichtigsten biogenen Rohstoffe ist in den meisten organischen und anorganischen Lösungsmitteln unlöslich. Grund dafür sind starke Wasserstoffbrückenbindungen zwischen den Cellulosesträngen. In koordinierenden Lösungsmitteln dagegen werden die intermolekularen Wasserstoffbrückenbindungen gebrochen; die Stränge werden voneinander separiert, und die Cellulose liegt molekulardispers gelöst vor. Beispiele für koordinierende Celluloselösungsmittel sind das seit langem bekannte Schweizersche Reagenz, eine wässrig alkalische Lösung von Cu(OH)2 in überschüssigem Ammoniak, sowie die neuentwickelten Systeme Pd-en, Ni-tren, Cd-tren und Zn-dien. Die Anhydroseglucoseeinheiten der Cellulose werden an ihren sekundären Hydroxylgruppen deprotoniert und binden als 1,2-Diolato-Liganden an die Metall-Amin-Fragmente (Abb. 11).
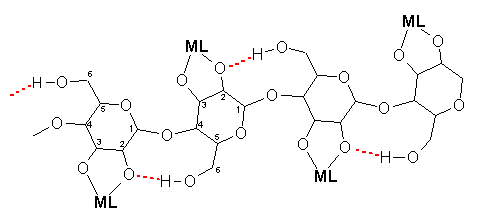
Abb.11: Schematische Darstellung der Bindungsverhältnisse in einem metallkomplexierten Cellulosestrang:
für ML = Pd(en)2+ , Ni(tren)2+, Cd(tren)2+, oder Zn(dien)2+.
Die Wasserstoffbrücken-Bindungen sind rot dargestellt.
Das in Abb. 1 skizzierte Strukturmodell von metallkomplexierter Cellulose konnte durch 13C-NMR-Untersuchungen, Lichtstreuexperimenten und Viskositätsmessungen aufgestellt werden [Kettenbach et al. 1997]. Mittels Modellverbindungen, also Verbindungen, die die komplexierte Cellulose nachbilden (zum Beispiel Saccharose und Trehalose) konnte man zeigen, dass die doppelt deprotonierten Glucopyranosyl-Reste chelatartig an die jeweiligen Metall-Ammin-Fragmente koordinieren. Auch nachweisen konnte man, dass im Cellulose-Metall-Komplex intramolekulare Wasserstoffbrücken-Bindungen vom Typ O–H···O– gebildet werden, die die Konformation der Saccharide maßgeblich beeinflussen. So ergab sich folgende Einteilung:
Einteilung metallhaltiger Celluloselösemittel
| Koordinierende Lösemittel | Nichtkoordinierende Lösemittel | ||||
|---|---|---|---|---|---|
| Name | Formel | auch... | Name | Formel | auch... |
| Cu-NH3 | [Cu(NH3)4](OH)2 | Cuoxam | Cd-en | [Cd(en)3] (OH)2 | Cadoxen |
| Cu-en | [Cu(en)2](OH)2 | Cuen | Co-en | [Co(en)3] (OH)2 | Cooxen |
| Cu-pp | [Cu(pp)2](OH)2 | Cu/pn | Ni-NH3 | [Ni(NH3)6] (OH)2 | Nioxam |
| Cd-tren | [Cd(tren)(OH)2] | Ni-en | [Ni(en)3] (OH)2 | Nioxen | |
| Ni-tren | [Ni(tren)(OH)2] | Zn-en | [Zn(en)3] (OH)2 | Zineoxen | |
| Pd-en | [Pd(en)(OH)2] | ||||
| Zn-dien | [Zn(dien)(OH)2] | ||||
Tab. 2: Liganden: en = Ethylendiamin, pp = 1,3-Propylendiamin,
tren = Tris(2-aminoethyl)amin, dien = Diethylentriamin
Die folgenden Abbildungen zeigen den Aufbau der Modellverbindungen:
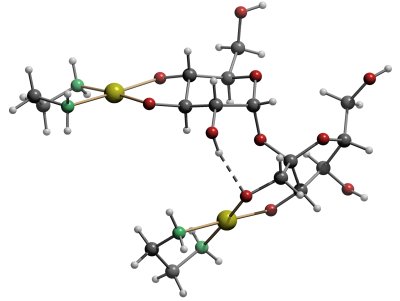 Die Molekülstruktur von [(en)2Pd2(Suc1,3,3´,4´H-4)]. (Suc = Saccharose, Rohrzucker)Pd: gelb, O: rot, N: grün. H-Brückenbindung: gestrichelt. |
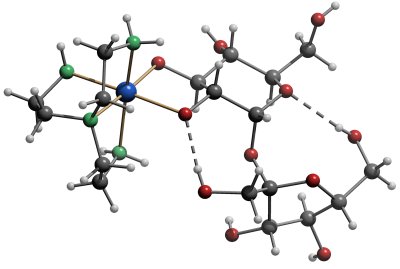 Die Molekülstruktur von [Ni(tren)(Suc2´,3´H-2)]. Ni: Blau, O: rot, N: Grün. H-Brückenbindungen: gestrichelt. |
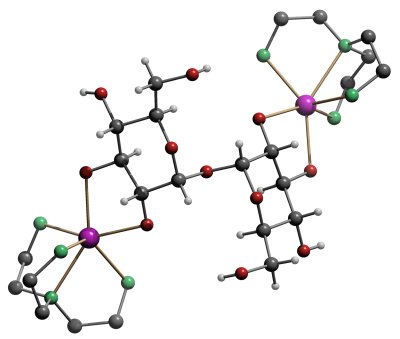 Die Molekülstruktur von [Cd2(tren)2(Tre2,3,2´,3´H-4)]. (Tre = a,a-Trehalose)Cd: violett, O: rot, N grün. |
