3.4 Die Verwendung von Kupferseide
3.4.1 Die Regeneratcellulosefaser
![Abb. 34: Spinndüsenformen [Schulz 2000]](../abb/faserform.gif) |
![Abb. 35: Faserquerschnitte,<br> mikroskopische Aufnahme [Schulz 2000]](../abb/faserquer.gif) |
| Abb. 34: Spinndüsenformen [Schulz 2000] | Abb. 35: Faserquerschnitte, mikroskopische Aufnahme [Schulz 2000] |
Der Hohlraum der Hohlfasern wird entweder mit Stickstoff oder mit einem unpolaren Lösungsmittel gefüllt. Verwendet man Spinndüsen mit schlitzförmigen Auslass, so bildet sich eine Regeneratcellulosefolie aus. Mit einer solchen Folie wird in dieser Ausarbeitung ein Modellversuch zur Dialyse (Kapitel 5.1.4.) durchgeführt.
Die Bedeutung des Kupferseideprozesses heute
Kupferseide hatte wie andere halbsynthetische Fasern ihre größte Bedeutung in der Zeit vor Einführung der vollsynthetischen Polymeren, wie den Polyamiden (zum Beispiel Nylon, Perlon) und Polyestern (zum Beispiel Trevira, Diolen). Die Verbesserung der Eigenschaften der vollsynthetischen Fäden hat zur Folge, dass die von der Cellulose abgeleiteten Fäden kaum mehr konkurrenzfähig sind. Auch unter dem Aspekt der Verfügbarkeit der Cellulose als nachwachsender Rohstoff werden derzeit der wirtschaftlichen Verwertung von Kupferseidefasern nur geringe Chancen eingeräumt. Trotzdem werden auch noch heute Kupferseidefasern unter dem Namen "Rayon" oder "Cupro-Rayon" von einer italienischen Textilfirma produziert und zu Geweben verarbeitet.
Die Herstellung von Hohlfasern hat indes heute große Bedeutung im medizinischen Bereich. So werden Kapillaren hergestellt, die unverzichtbar für die Hämodialyse und Hämofiltration (künstliche Niere!) sind. Dabei sind internationale Vorschriften (GMPs, GLPs) zu beachten, um die sachgerechte Herstellung von der Dialysatoren zu gewährleisten.
3.4.2 Dialysemembranen
Was bedeutet Dialyse?
Die Dialyse des Blutes (Hämodialyse) ist eine in der Medizin angewandte Technik, die es erlaubt, die Funktion von insuffizienten (funktionsunfähigen) Nieren teilweise zu ersetzen. Eine Niereninsuffizienz kann die Folge verschiedenster Krankheitsverläufe sein und erlaubt es dem Kranken nicht, das im Körper zuviel vorhandene Wasser, Salze (Osmoregulation) und Endprodukte des Stoffwechsels auszuscheiden, wie zum Beispiel die wasserlöslichen stickstoffhaltigen Endprodukte des Proteinstoffwechsels oder des normalen Zellabbaus des Gewebes (Harnstoff). Weitere beeinträchtige Funktionen der Nieren sind die Regulation des Säuren- und Basenhaushalts (Konstanthaltung des pH-Wertes des Blutes), die innere Sekretion von Gewebehormonen (Renin, Erythropoetin) und Aufgaben im Intermediärstoffwechsel (Kohlenhydratstoffwechsel, Fettstoffwechsel, Knochenstoffwechsel).
![Abb. 37: Hämodialyse Schema [Lerch 2000]](../abb/dialyse1_kl.jpg) Zum Vergrössern anklicken! |
Bei der Dialyse bedient man sich der „künstlichen Niere“. Das Blut des Nierenkranken wird dabei aus dem Körper zu dem Gerät geführt und dort mittels einer speziellen Membran gegen eine wässerige Salzlösung, dem sogenannten Dialysat, dialysiert (Abb. 37). Eine „künstliche Niere“ wirkt in mehrfacher Weise. Mit ihr kann der Wasser- und Salzhaushalt des Körpers, jedoch auch die Konzentration von chemischen Substanzen im Blut kontrolliert und der Blut-pH-Wert reguliert werden. |
| Abb. 37: Hämodialyse Schema [Lerch 2000] |
Der Dialysator
![Abb. 38: Dialysemembran [Kütemeyer 2000]](../abb/dialyse2_kl.gif) Zum Vergrössern anklicken! |
Bei der Dialyse wird das Blut des Patienten beim Durchfließen eines Filters von den harnpflichtigen Substanzen befreit. Dieses Filter nennt man Dialysator. Vereinfacht kann man sagen, dass eine verunreinigte Lösung (das giftbeladene Blut des Patienten), durch eine Membran getrennt, von der Waschlösung (Dialysierflüssigkeit) umströmt wird. Die Dialysemembran ist nur für bestimmte Stoffe durchlässig und entspricht in ihrer Wirkung einem Filter mit mikroskopisch kleinen Poren. Die Größe dieser Poren bestimmt, welche Stoffe durch die Membran hindurchtreten können. Als Materialien für die Membranen der Dialysatoren werden neben Regeneratcellulose Celluloseacetat, Polyacrylnitril und Polysulfon eingesetzt. |
| Abb. 38: Dialysemembran [Kütemeyer 2000] |
Der Aufbau der Membran im Dialysator kann entweder hohlfaserförmig (Kapillardialysator) oder schichtförmig (Plattendialysator) sein. Der heute meist verwendete Kapillardialysator besteht aus mehreren Tausend gebündelten Kapillaren, deren Wandungen die Membran bilden. Dies wird in folgenden Abbildungen deutlich: (Quelle Membrana 2001)
![Abb. 39: Kapillarenform [Membrana 2001]](../abb/faserbdl1.jpg) |
Die Kapillaren werden in einer Form aneinander gereiht und mit einer Folie so umklebt, dass sie zusammen halten. |
| Abb. 39: Kapillarenform [Membrana 2001] | |
![Abb. 40: Faserbündel [Membrana 2001]](../abb/faserbdl2.jpg) |
Man erhält die Faserbündel (hier sechs Stück). |
| Abb. 40: Faserbündel [Membrana 2001] | |
![Abb. 41: Faserbündel im Durchlicht [Membrana 2001]](../abb/faserbdl3.jpg) |
Mit Durchlicht wird die Qualität der Faserbündel kontrolliert. |
| Abb. 41: Faserbündel im Durchlicht [Membrana 2001] | |
![Abb. 42: Dialysator (Aufsicht) [Membrana 2001]](../abb/faserbdl4.jpg) |
Das Faserbündel wird jetzt an den Enden mit Harz verklebt und in ein Plastikrohr gegeben. Dieses Plastikrohr hat zwei seitliche Anschlüsse für den Durchlauf der Waschlösung. Oben und unten erhält der Dialysator die Anschlüsse für den Blutdurchlauf. |
| Abb. 42: Dialysator (Aufsicht) [Membrana 2001] | |
![Abb. 43: Faserquerschnitt unter dem Mikroskop [Membrana 2001]](../abb/faserbdl5.jpg) |
Die verklebten Enden des Faserbündels werden auf die Länge des Plastikrohrs gekürzt. Unter dem Mikroskop wird kontrolliert, ob die Kapillaren an den verklebten Faserbündelenden auch nicht vom Kleber verstopft sind. |
| Abb. 43: Faserquerschnitt unter dem Mikroskop [Membrana 2001] |
Funktionsweise eines Dialysators
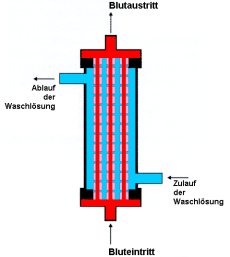 |
Beschreibung Abb.44: Das Blut (rot) durchläuft die Kapillaren hier von unten nach oben. Auf dieser Wegstrecke finden die Filtrationsprozesse statt. Die Waschlösung (blau) umspült die Kapillaren, nimmt das Filtrat auf und wird nach dem Ablauf wieder gereinigt. |
| Abb. 44: Dialysator (Schema) |
Der ideale Dialysator hat eine große Austauschfläche, ein kleines Gehäuse sowie gute Clearance-Daten, das heißt, der Austausch möglichst vieler Giftstoffe soll in kurzer Zeit erfolgen. Der Direktkontakt mit dem Blut verlangt eine gute Biokompatibilität (Verträglichkeit) der Materialien und des Desinfektionsmittels. Darüber hinaus soll der Dialysator im Preis günstig und leicht bedienbar sein. Die Sterilisation erfolgt heute meist noch mit Ethylenoxyd, jedoch setzen sich mehr und mehr dampfsterilisierte (autoklavierte) oder gammastrahlen-sterilisierte Dialysatoren durch. Als großflächig bezeichnet man Dialysatoren mit einer Oberfläche ab 1,6 m2. Von sogenannten High-flux-Dialysatoren spricht man, wenn der Ultrafiltrationsfaktor über 10–15 mL mm Hg–1 h–1 und ein besonders hoher Giftstofftransport möglich ist. [Kütemeyer 2000]
Die Cellulosemembran
Die in der Vergangenheit wichtigste Gruppe von Membranen aus stellen die Cellulosemembranen dar. Heute wird Cellulose in verschiedenen chemischen Modifikationen als Membran für die Dialyse angeboten. Hierzu gehören in erster Linie die Regeneratcellulose, die bei den Dialysemembranen auch heute noch zu den wichtigsten gehört und in der Vergangenheit als Standard der Dialysemembran betrachtet wurde. Bei der Regeneratcellulose wird die natürliche Zellulose chemisch unverändert zu Membranen verarbeitet; ein Beispiel ist Cuprophan® der MEMBRANA AG . Die nach dem Kupferseideprozess hergestellten Membranen sind robust und leicht zu handhaben, weisen aber eine erhebliche Aktivierung des Komplementsystems, das heißt eine messbare Inkompatibilität mit dem Blut, auf [von Sengbusch 2000].
So hat man schon bereits früh versucht, Cellulose zu verändern, um die beobachtete Inkompatibilität zu verhindern. Ein Argument, das gegen Cellulosemembranen angeführt wird, ist die niedrige Molekülausschlussgrenze von ca. 5000 u, die deutlich niedriger als bei synthetischen Polymeren liegt (15000 u). Dieses Argument bezieht sich aber auf die Frühzeit der Dialyse, in der fast ausschließlich mit sogenannten „Low-flux“-Cellulosemembranen gearbeitet wurde. In der Zwischenzeit wurden aber auch „High-flux“-Cellulosemembranen entwickelt, die den Durchtritt mittelgroßer Moleküle bis zu 15000 u ermöglichen, so dass hinsichtlich der Low- und High-flux Eigenschaften kein Unterschied zwischen cellulosischen und synthetischen Materialen besteht. Das Problem der Inkompatibilität mit dem Blut versucht man zu lösen, indem man die Cellulosemembranen modifiziert (Benzylcellulose) und/oder sie mit synthetischen Polymeren beschichtet [von Sengbusch 2000].
Ob die Zukunft reinen Cellulosemembranen, chemisch modifizierten Cellulosemembranen, Membranen aus synthetischen Polymeren oder einer Kombination verschiedener Membrantypen (zum Beispiel synthetisch beschichteten Cellulosemembranen) gehören wird, ist derzeit noch eine offene Frage.
