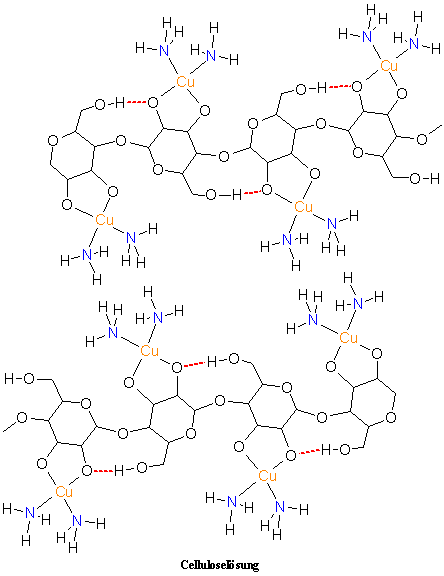
3.2 Chemische Grundlagen
Der grundlegende Vorgang für die Gewinnung der Kupferseide ist die Auflösung von Cellulose in einer Lösung von Kupferhydroxid (Cu(OH)2) in konzentriertem wässrigem Ammoniak (NH3). In der Lösung liegt vor allem Tetrammin-Kupfer(ii)-Hydroxid, [CuII(NH3)4](OH)2, vor. Die celluloselösende Wirkung dieser Lösung wurde von Schweizer im Jahre 1857 entdeckt und man bezeichnet diese daher auch als „Schweizers Reagenz“.
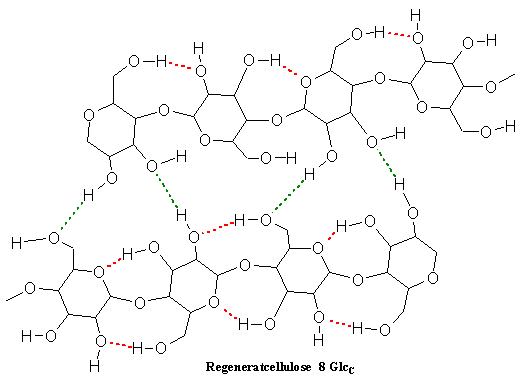
Zur Herstellung von Fasern oder Folien aus Cellulose wird die gelöste Cellulose in einer alkalischen Lösung (Fällbad) ausgefällt und in Schwefelsäure von Kupfer befreit. So erhält man die ursprüngliche Cellulose wieder — die Cellulose wird regeneriert, man spricht daher von Regeneratcellulose. Heute werden auf der Basis dieses Regeneratverfahrens (in einer alkalischen Variante) vor allem Membranen aus Cellulose für die Blutwäsche bei niereninsuffizienten Patienten hergestellt.
3.2.1 Schweizers Reagenz, Cu-NH3
Eine Kupfersulfatlösung wird mit einem Gemisch aus konzentrierter Natronlauge und Ammoniak versetzt (siehe Arbeitsvorschrift: Herstellung des Kupferhydroxids). Das dabei ausfallende Kupfer(ii)-hydroxid, Cu(OH)2, wird abgetrennt und mit konzentriertem Ammoniak in Lösung gebracht.
Reaktionsgleichung:
Cu(OH)2 + x NH3 → [Cu(NH3)x](OH)2
Durch die Bildung von Kupfer-Ammoniak-Komplexen färbt sich die Lösung intensiv blau. Die Anzahl x der Ammoniakliganden ist von der Zusammensetzung der Lösung abhängig. Die Hauptmenge des Kupfers liegt als Tetrammin-Komplex (x = 4) vor; bei hoher NH3-Konzentration wird auch der Pentammin-Komplex (x = 5) gefunden.
In der Praxis werden pro mol Kupferhydroxid ca. 90 mol Ammoniak zugesetzt, da sonst das schwerlösliche Kupferhydroxid nicht in Lösung geht.
3.2.2 Herstellung der Celluloselösung
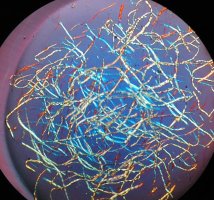
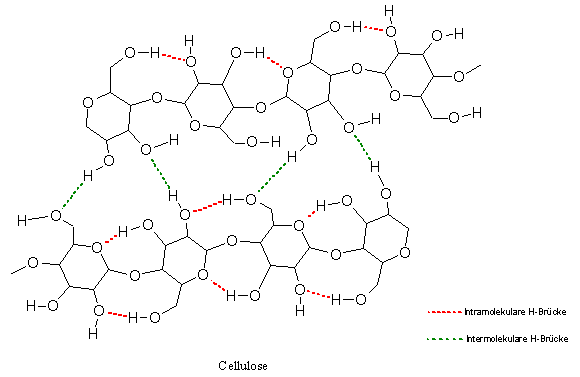
Wird Baumwoll-Linters oder Watte (siehe 5.1.1 Lösen von Cellulose) mit Schweizers Reagenz versetzt, beginnt sich die Cellulose aufzulösen. Beobachtet man den Auflösungsvorgang im Mikroskop, so sieht man zunächst, wie die gewundenen Baumwollfasern sich gleichsam aufdrehen und stark verkürzen (s. Abb. 21, 22).
 |
 |
| Abb. 21: Cellulose in SCHWEIZERs Reagenz (zu Beginn) |
Abb. 22: Cellulose in SCHWEIZERs Reagenz (nach einigen Minuten) |
Nach der Auflösung der Cellulose ist die Lösung klar. Das Auflösen der Cellulose im Schweizers Reagenz ist stark abhängig von der Konzentration des Ammoniaks und von der Menge an verwendeter Cellulose. In der Praxis hat es sich gezeigt, dass Lösungen mit einem Cellulosegehalt bis zu 7 % am schnellsten herzustellen sind, und dass es besser ist, das Schweizersche Reagenz direkt zusammen mit Cellulose anzusetzen, da dadurch kein so großer Überschuß an Ammoniak notwendig ist.
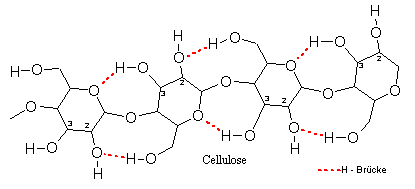
Der Lösevorgang von Cellulose im Schweizers Reagenz kann als der Aufbau einer Komplexverbindung beschrieben werden (zum besseren Verständnis siehe „3.2.7 Kurze Einführung in die Komplexchemie)“. Dabei kommt es zum Ligandenaustausch im Kupfer(ii)-tetrammin-Komplex. Es werden 2 Amminliganden von den deprotonierten 2- und 3-ständigen Alkoholresten einer Anhydroglucoseeinheit verdrängt, das Zentralatom Kupfer (Cu) bindet an die Sauerstoffatome O-2 und O-3 einer Anhydroglucoseeinheit. Die Anhydroglucoseeinheit fungiert als Chelatligand. Damit werden die Wasserstoffbrückenbindungen zwischen den einzelnen Cellulosemolekülketten gebrochen und kristalline Bereiche in der Cellulose abgebaut.
Reaktionsgleichung:
| GlcC + Cu(NH3)4(OH)2 → | Cu(NH3)2(GlcCH–2) + 2 H2O + 2 NH3 |
| Cellulose | Celluloselösung |
Strukturvorstellung:
Dargestellt sind vier Anhydroglucose-Einheiten.
4 GlcC (Cellulose) + 4 [Cu(NH3)4](OH)2
– 8 H2O![]() – 8 NH3
– 8 NH3
4 Cu(NH3)2(GlcCH – 2)
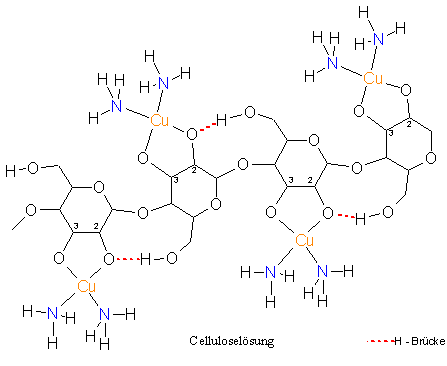
3.2.3 Normannsche Verbindung, Kupferalkalicellulose
Wird die Celluloselösung mit Natronlauge umgesetzt, fällt eine Natrium und Kupfer enthaltende Celluloseverbindung aus, die nach dem Entdecker als Normannsche Verbindung bezeichnet wird. Bei der Folienherstellung wird die Normannsche Verbindung auch als „Blaufilm“ bezeichnet, da sie eine dunkelblaue, feste Masse darstellt. Durch Erhöhung des pH-Werts durch Natronlauge werden die in der Celluloselösung noch vorhandenen Amminliganden verdrängt, so dass in der dabei entstehenden Normannschen Verbindung die Kupferionen jeweils durch zwei Chelatliganden koordiniert sind.
Reaktionsgleichung:
| 2 [Cu(NH3)2(GlcCH–2)] + 2 NaOH → | Na2[Cu(GlcCH–2)2] + Cu(NH3)4(OH)2 |
| Celluloselösung | Normannsche Verbindung |
Strukturvorstellung:
In diesem Beispiel reagieren zwei Moleküle (mit jeweils 4 Glucoseeinheiten) der Celluloselösung zur Normannschen Verbindung.
8 Cu(NH3)2(GlcCH–2)
Celluloselösung
+ 8 NaOH![]() – 4 [Cu(NH3)4](OH)2
– 4 [Cu(NH3)4](OH)2
4 Na2[Cu(GlcCH – 2)2]
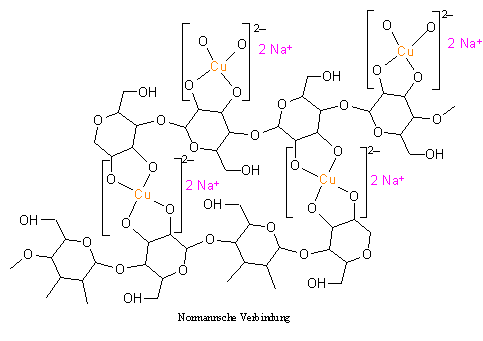
In der Normannschen Verbindung ist das Kupferatom durch vier Sauerstoffatome in einem quadratisch-planaren Komplex gebunden. Es wird deutlich, dass die Celluloseketten durch die Kupferatome miteinander verbunden werden und so ein zweidimensionales Netzwerk ausbilden. Die Normannsche Verbindung ist daher schwerlöslich und fällt nach ihrem Entstehen aus. Je nach Fällbedingungen kann sie in Form von Folien oder Fäden erhalten werden. Da die Normannsche Verbindung Kupfer und Natrium (Alkalielement) enthält, bezeichnet man sie auch als „Kupferalkalicellulose“.
3.2.4 Cupricellulosat
Im nächsten Schritt wird die entstandene Normannsche Verbindung in destilliertes Wasser eingelegt. Es entsteht das Cupricellulosat, ein türkisfarbener Film, der aufgrund seiner Farbe in der Industrie auch „Grünfilm“ genannt wird. Chemisch betrachtet werden bei der Reaktion der Normannschen Verbindung mit Wasser vermutlich die Natriumionen ausgetauscht, da Natronlauge entsteht. In der Literatur gibt es keine Hinweise zur Struktur des Cupricellulosats. [Klüfers et al. 1997]
Die Reaktion kann durch folgende Reaktionsgleichung beschrieben werden:
| Na2[Cu(GlcCH–2)2] + 2 H2O → | Cu(GlcCH–1)2 + 2 NaOH |
| Normannsche Verbindung | Cupricellulosat |
Strukturvorstellung, dargestellt an zwei Anhydroglucoseeinheiten
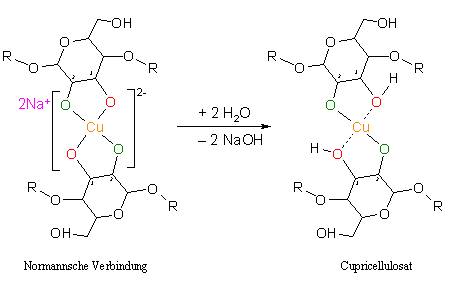
Das Kupfer ist hier über die zwei deprotonierten Alkoholreste (grün) und über zwei Hydroxygruppen (rot) von gegenüber liegenden Glucoseeinheiten komplexiert. Bei der Reaktion der Normannschen Verbindung mit Wasser wird ein bindendes Sauerstoffatom (zum Beispiel O-3) protoniert und es bildet sich Natronlauge. Diese Protolyse wiederholt sich nochmals und es bildet sich Cupricellulosat.
Strukturvorstellung:
4 Na2[Cu(GlcCH– 2)2]
Normannsche Verbindung
+ 8 H2O![]() – 8 NaOH
– 8 NaOH
4 Cu(GlcCH– 1)2
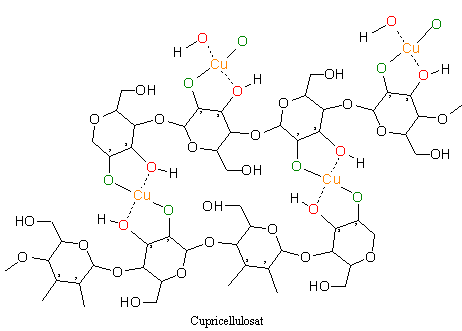
3.2.5 Regenerierung der Cellulose
Im letzten Schritt des Kupferseideprozesses wird die Regeneratcellulose hergestellt. Dazu gibt man das türkisfarbene Cupricellulosat in starke Säure (Schwefelsäure). Man beobachtet, dass das Cupricellulosat sehr schnell farblos wird und sich die Säure blau färbt.
Reaktionsgleichung:
| Cu(GlcCH–1)2 + H2SO4 → | 2 GlcC + CuSO4 |
| Cupricellulosat | Cellulose |
Die Kupferatome werden durch Protonen ersetzt und treten aus der Cellulose-Komplexverbindung, dem Cupricellulosat, aus. Es wird Cellulose freigesetzt, jedoch in einer anderen Form als das Ausgangsprodukt. Es ist die Regeneratcellulose entstanden. Die Säurelösung färbt sich durch die freiwerdenden Cu2+-Ionen blau. Der Vorgang wird als Entkupfern bezeichnet.
4 Cu(GlcCH– 1)2
Cupricellulosat
+ 4 H2SO4 ![]() – 4 CuSO4
– 4 CuSO4
8 GlcC
3.2.6 Die chemischen Reaktionen im Überblick
Durch 3 verschiedene Darstellungsmöglichkeiten soll der folgende Gesamtüberblick die räumliche Anordnung der Moleküle verdeutlichen.
- Durch Klicken auf die Strukturen wird ein Kugel-Stab-Modell geöffnet.
- Die Struktur lässt sich mit einem Java-Applet bewegen.
- Für Windows- Rechner, kann die Struktur mit Hilfe des Chime-Plugins betrachtet werden.

Die Reaktion des Kupferseideprozesses wird an zwei Cellulosesträngen mit jeweils vier Glucoseeinheiten dargestellt. So reagieren 8 Glucoseeinheiten (GlcC).
- Grafik „anklicken“ oder hier für ein Kugel-Stab-Modell
- Struktur bewegen mit Java-Applet.
- Struktur bewegen mit Chime-Plugin.
| 8 Cu(OH)2 + 32 NH3 → | Cu(NH3)4(OH)2 (Schweizers Reagenz) |
| + 8 GlcC(Cellulose) |
– 16 H2O ![]() – 16 NH3
– 16 NH3
Die intermolekularen H-Brückenbindungen
werden gespalten.
- Grafik "anklicken" für Kugel-Stab-Modell
- Struktur bewegen mit Java-Applet.
- Struktur bewegen mit Chime-Plugin.
+ 8 NaOH![]() – 4 [Cu(NH3)4](OH)2
– 4 [Cu(NH3)4](OH)2
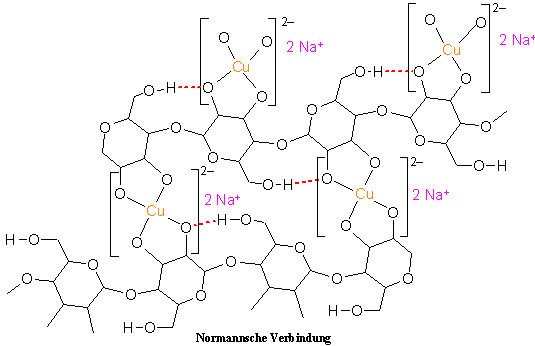
4 Na2[Cu(GlcCH – 2)2]
- Grafik "anklicken" für Kugel-Stab-Modell
- Struktur bewegen mit Java-Applet.
- Struktur bewegen mit Chime-Plugin.
+ 8 H20![]() – 8 NaOH
– 8 NaOH
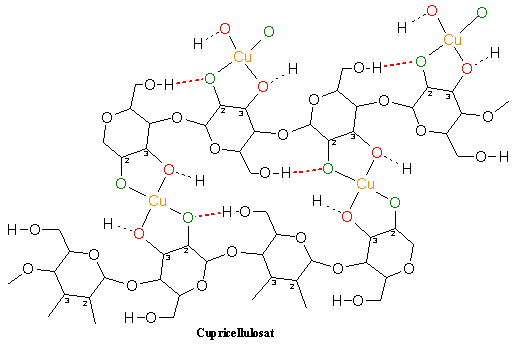
4 Cu(GlcCH– 1)2
- Grafik "anklicken" für Kugel-Stab-Modell
- Struktur bewegen mit Java-Applet.
- Struktur bewegen mit Chime-Plugin.
+ 4 H2S04![]() – 4 CuSO4
– 4 CuSO4
- Grafik "anklicken" für Kugel-Stab-Modell
- Struktur bewegen mit Java-Applet.
- Struktur bewegen mit Chime-Plugin.
3.2.7 Kurze Einführung in die Komplexchemie
Komplexe bestehen aus einem Zentralion (zum Beispiel Cu), das von Liganden (im Kupferseideprozess NH3 oder OH–) umgeben ist. Die Gesamtzahl der Ligatoratome (Atome, die an das Zentralion binden) ist die Koordinationszahl.
Wie sind die Liganden um das Zentralion angeordnet? — Das Zentralmetall ist oft von sechs Liganden oktaedrisch umgeben. Neben Komplexen mit fünf Liganden in trigonal-bipyramidaler und quadratisch-pyramidaler Anordnung kommen auch häufig Komplexe mit vier Liganden in tetraedrischer oder quadratisch-planarer Umgebung vor.
Welche chemischen Eigenschaften müssen Liganden besitzen? — Liganden müssen mindestens ein freies Elektronenpaar besitzen, das zum Bindungselektronenpaar zwischen Zentralion und Ligand wird. Es kommen Dipolmoleküle und Anionen, seltener Kationen, in Frage; Liganden müssen Lewis-Basen sein.
Koordinative oder dative Bindung. — Die Komplexbindung ist eine Donor-Akzeptor-Bindung zwischen Liganden (Lewis-Base = Elektronenpaar-Donor) und Zentralion (Lewis-Säure = Elektronenpaar-Akzeptor). Sie ist je nach Art des Zentralions und des Liganden mehr oder weniger polar. Sie kann von einer elektrostatischen Anziehung bis zu einer unpolaren Elektronenpaarbindung variieren.
Ligandenaustausch, Lösungsgleichgewichte. — Farbänderungen von Übergangsmetallsalzlösungen sind ein Hinweis auf den Austausch von Liganden. Versetzt man zum Beispiel eine wässrige Cu2+-Lösung mit Ammoniak, dann verfärbt sie sich schnell tiefblau:
| [Cu(H2O)6]2+ + 4 NH3 → | [Cu(NH3)4(H2O)2]2+ + 4 H2O |
| Hexaquakupfer(ii)-Ion | Tetrammin-diaqua-kupfer(ii)-Ion |
Verdünnt man diese wässrige Lösung von Tetramminkupfer(II)-Ionen mit Wasser, so bleibt der Farbton erhalten, das Komplex-Ion ist stabil. Im Gegensatz dazu ist das Hexaquakupfer(II)-Ion weniger stabil; es reagiert schnell bei Ammoniakzugabe.
Eine angesäuerte Lösung von Eisen(iii)-chlorid ist durch die vorhandenen [FeCl(H2O)5]2+-Ionen gelb. Bei Zugabe von etwas Thiocyanat-Lösung wird die Lösung tiefrot. Sie wird wieder gelb, wenn die Konzentration der Chlorid-Ionen stark erhöht wird. Chlorid-Ionen und Thiocyanat-Ionen können gegeneinander ausgetauscht werden. Es liegt das folgende Ligandenaustausch-Gleichgewicht vor:
| [FeCl(H2O)5]2+ + 4 SCN– → | [FeSCN(H2O)5]2+ + Cl– |
| gelb | rot |
In Lösungen mit verschiedenen Liganden bildet sich die stabilere Komplexverbindung, hier der Eisen(iii)-thiocyanat-Komplex. Die Stabilitätskonstante ist die Gleichgewichtskonstante der Komplexbildungsreaktion, sie beschreibt die Stabilität des Komplexes quantitativ. Für das Tetramminkupfer(ii)-Ion errechnet sich die Stabilitätskonstante folgendermaßen:
Reaktion:
| Cu2+(aq) + 4 NH3 → | [Cu(NH3)4]2+ |
| Tetramminkupfer(ii)-Ion | |
| β = c([Cu(NH3)4]2+) / c(Cu2+) · c4(NH3) = 1013 l4 mol–4 | |
Bestimmt man bei bekannten Ausgangsmengen der Komponenten des Lösungsgleichgewichts die Konzentration einer Spezies, zum Beispiel des Komplexes, so kann man die Stabilitätskonstante berechnen. Die Geschwindigkeit, mit der sich das Lösungsgleichgewichte einstellt, ist unabhängig von der Stabilität eines Komplexes. Löst man zum Beispiel eine Spatelspitze Chrom(iii)-chlorid in Wasser, ändert sich die Farbe dieser Lösung erst nach einigen Tagen. Manche Komplexverbindungen (vor allem Criii-, Coiii- und Ptii-Komplexe) tauschen ihre Liganden nur langsam aus. Das Gleichgewicht stellt sich erst nach längerer Zeit ein. Die geringe Reaktionsgeschwindigkeit kann eine hohe Stabilität vortäuschen. Solche Komplexe bezeichnet man als inert. Das Gegenteil davon sind labile Verbindungen, bei denen der Ligandenaustausch schnell abläuft, wie zum Beispiel beim obigen Hexaquakupfer(ii)-Ion.
Im Kupferseideprozess treten labile und gleichzeitig stabile Komplexverbindungen auf. Nur so ist es möglich, dass der Kupferseideprozess überhaupt ablaufen kann, da hier Kupfer, als Zentralatom, mit wechselnden Liganden (NH3, Cellulose, OH–) stabile und labile Komplexverbindungen eingeht.
Chelatkomplexe. — Es gibt Liganden, die zwei oder mehr Bindungen eingehen können. Solche Liganden mit mehreren Bindungsstellen nennt man mehrzähnige Liganden (zwei Bindungen = zweizähnig, drei Bindungen = dreizähnig, etc.). Die Liganden greifen wie eine Krebsschere nach dem Zentralion, und man bezeichnet daher diese Komplexe als Chelatkomplexe (von lat. chelae, Krebsschere).
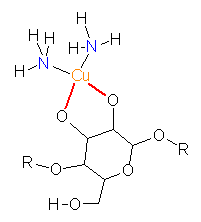 |
Beispiel: Zucker binden als Polyole (mehrwertige Alkohole) über die deprotonierten Hydroxygruppen an das Zentralatom. Im Formelbild, das eine Celluloselösung in Schweizers Reagenz beschreibt, wird dies deutlich. Der Anhydroglucose-Ligand komplexiert das Kupferatom über zwei Bindungsstellen (rot). Die Anhydroglucose ist somit ein zweizähniger Chelatligand. |
Chelatkomplexe sind stabiler als Komplexe mit chemisch ähnlichen einzähnigen Liganden. Dieser Chelateffekt ist im wesentlichen ein Entropieeffekt. Der Austausch von einzähnigen Liganden gegen einen Chelatbildner führt zu einer größeren Anzahl von freien Teilchen, und somit zu einer Zunahme der Entropie. Die Bildung eines Chelatkomplexes wird dadurch erleichtert.
Beispiel:
| [Ni(NH3)6]2+ + 3 en → | [Ni(en)3]2+ + 6 NH3 |
| 4 Teilchen | 7 Teilchen |
„en“ ist die Abkürzung für den zweizähnigen Liganden 1,2-Diaminoethan (Ethylendiamin).
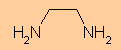
Ein 1,2-Diaminoethan-Molekül besitzt zwei Stickstoffatome mit freien Elektronenpaaren, die mit dem Nickel-Ion in Wechselwirkung treten können.